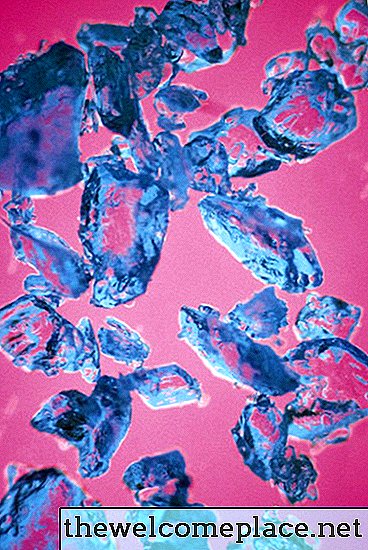
Comme beaucoup de complexes de métaux de transition, le sulfate de cuivre (II) pentahydraté est de couleur vive; les cristaux de cette belle substance ont une nuance de bleu pâle. Sa couleur découle de la chimie et de la physique de sa composition, ou plus précisément du type de liens qu’elle forme avec les ions sulfate et les molécules d’eau attachées au cuivre.
 Le sulfate de cuivre pentahydraté a une belle couleur bleue translucide.
Le sulfate de cuivre pentahydraté a une belle couleur bleue translucide.Orbitales
Les électrons présentent une dualité onde-particule, ce qui signifie qu'ils ont à la fois des propriétés analogues à celles des ondes et des particules. Le comportement d'un électron dans un atome est décrit par une équation semblable à une onde appelée fonction d'onde. Le carré de la fonction d'onde donne la probabilité que l'électron se trouve à un point donné à un moment donné. Les fonctions d'onde des électrons dans les atomes s'appellent également des orbitales atomiques. Les chimistes nomment les orbitales atomiques en utilisant un chiffre pour désigner le niveau d'énergie de l'orbitale suivi d'une lettre pour désigner le type d'orbitale. Pour les éléments de la quatrième période du tableau périodique ou au-dessus, il suffit de se concentrer sur trois types d'orbitales, à savoir, s, p et d. Pour avoir une idée de la forme de ces orbitales, voir le lien dans la section des ressources.
Division de champ de cristal
L'ion cuivre dans le sulfate de cuivre (II) a perdu deux électrons, il a donc une charge de +2. Il a neuf électrons dans son niveau d'énergie ultime ou dans sa coquille; ces soi-disant électrons de valence occupent tous des orbitales 3d. Les molécules d'eau et les ions sulfates sont attirés par la charge positive de l'ion cuivre. Ils s'en approchent et s'organisent autour d'eux sous une configuration octaédrique. En conséquence, deux des cinq orbitales 3d des ions cuivre s'alignent le long des axes par lesquels les ions sulfate et les molécules d'eau s'approchent; comme les électrons dans ces orbitales et les électrons dans les molécules / ions ont une charge négative, ils se repoussent mutuellement. En fin de compte, deux des cinq orbitales 3d ont augmenté leur énergie; ce sont les orbitales, par exemple. Les trois autres, en revanche, ont une énergie réduite et sont appelées les orbitales t2g.
Absorption de la lumière
Un complexe de coordination absorbera un photon de lumière s'il possède une énergie équivalente à la différence entre l'état occupé par un électron et l'énergie d'un autre état disponible. Par conséquent, le complexe de sulfate de cuivre peut absorber des photons de lumière avec des énergies équivalentes à la différence d'énergie entre t2g et, par exemple, les orbitales. En l'occurrence, la différence d'énergie pour le complexe de sulfate de cuivre est équivalente à la différence d'énergie pour les photons de lumière dans la région rouge-orange du spectre. Étant donné que la lumière rougeâtre est absorbée pendant que la lumière bleue est transmise, le sulfate de cuivre apparaît en bleu.
Se dissoudre dans l'eau
Lorsque le sulfate de cuivre se dissout dans l'eau, les ions cuivre et sulfate se dissocient. Maintenant, l'ion cuivre forme un complexe octaédrique où il est entouré de six molécules d'eau. Toutefois, l’effet reste très similaire car la séparation entre les orbitales t2g et les orbitales de ce nouveau complexe est toujours telle que la lumière rouge-orange est absorbée et que vous voyez une solution de couleur bleue.